الرابطة الأيونية: ما هي ، وكيف تتكون الرابطة الأيونية؟
الرابطة الأيونية (وتسمى أيضًا الرابطة الكهربية التساهمية) هي نوع من الروابط الكيميائية تحدث عندما تتخلى ذرة عن إلكترون للآخر من أجل تحقيق الاستقرار الإلكتروني لكليهما.
يحدث هذا الترابط عادةً بين العناصر المعدنية وغير المعدنية ذات القدرة الكهربية المختلفة ، مما يعني أن العناصر لها قدرة مختلفة على جذب الإلكترونات. بشكل عام ، العناصر المعدنية على استعداد للتبرع بإلكترون بينما اللافلزات مستعدة لأخذها.
تسمى الروابط الأيونية لأنها تنتج الأيونات في عمليتها. دعونا نرى: عندما يحدث انتقال الإلكترونات بين الذرات ، يصبح المتبرع أيونًا موجبًا يسمى الكاتيون ، مما يعني أنه يكتسب شحنة موجبة. من جانبها ، يتحول المستقبل إلى أيون سالب يسمى الأنيون.
الروابط الأيونية هي واحدة من ثلاثة أنواع من الروابط الكيميائية الموجودة ، إلى جانب الروابط التساهمية والروابط المعدنية. الروابط الأيونية هي الروابط الأكثر شيوعًا التي تشارك في تكوين المركبات غير العضوية.
خصائص الروابط الأيونية
ترتبط خصائص الروابط الأيونية بالعناصر التي تتدخل فيها ، وعملية الاتحاد ونتائجا.
- تحدث بين العناصر الفلزية (المجموعتان الأولى والثانية) واللافلزات (المجموعتان السادس والسابع) في الجدول الدوري.
- يجب أن يكون للذرات التي تشكلها اختلافات في الكهربية عن بعضها البعض.
- هم نتاج نقل الإلكترونات.
- يتم تحويل ذراته إلى كاتيونات وأنيونات بعد انتقال الإلكترونات ، مما ينتج عنه الرابطة.
- إنها روابط قوية ولكنها صلبة بسبب التجاذب بين الشحنات السالبة والموجبة.
مميزات الرابطة الأيونية
تقدم المركبات المكونة من الروابط الأيونية سلسلة من الخصائص نتيجة التجاذب القوي بين الشحنات التي تحدث في الروابط المذكورة ، مما يحدد سلوكها الكيميائي. يسمى.
- إنها محايدة في الحالة الصلبة: عندما تكون في الحالة الصلبة ، تكون الشحنة الكهربائية للروابط الأيونية متعادلة.
- تميل إلى التبلور: نظرًا للبنية ثلاثية الأبعاد للرابطة الأيونية ، فإنها تفضل الشبكات المتبلورة الهشة.
- نقاط غليان وانصهار عالية (300 درجة مئوية إلى 1000 درجة مئوية): نظرًا لوجود قوة جذب قوية جدًا بين الأيونات ، يجب أن تخضع لنقاط انصهار أو غليان عالية لتعديل حالتها.
- صلبة عند درجات حرارة تتراوح بين 20 و 30 درجة مئوية: وبالتالي ، عادة ما تكون الروابط الأيونية صلبة في درجة حرارة الغرفة.
- الموصلات الجيدة للكهرباء: الروابط الأيونية هي موصلات جيدة للكهرباء طالما أنها تذوب في الماء.
كيف تتكون الرابطة الأيونية؟
- عندما يجتمع عنصر معدني وغير معدني معًا ، فإنهم يسعون إلى الاستقرار الإلكتروني. سيكون المعدن على استعداد للتبرع بإلكترون تكافؤ من غلافه الخارجي ، في حين أن اللافلزات ستكون على استعداد لتلقي الإلكترون المذكور من غلافه الخارجي.
- بمجرد أن ينقل العنصر المعدني إلكترونه ، فإنه يكتسب شحنة موجبة ، أي يصبح كاتيون (أيون موجب). من جانبه ، يكتسب اللافلز شحنة سالبة عند استقبال الإلكترون وبالتالي يصبح أنيونًا (أيون سالب).
- تولد الشحنات الموجبة والسالبة للأيونات فورًا قوة جذب تربطهما معًا. وهكذا ، يتم توحيد الرابطة الأيونية.
ما هي عملية تكوين الرابطة الأيونية؟
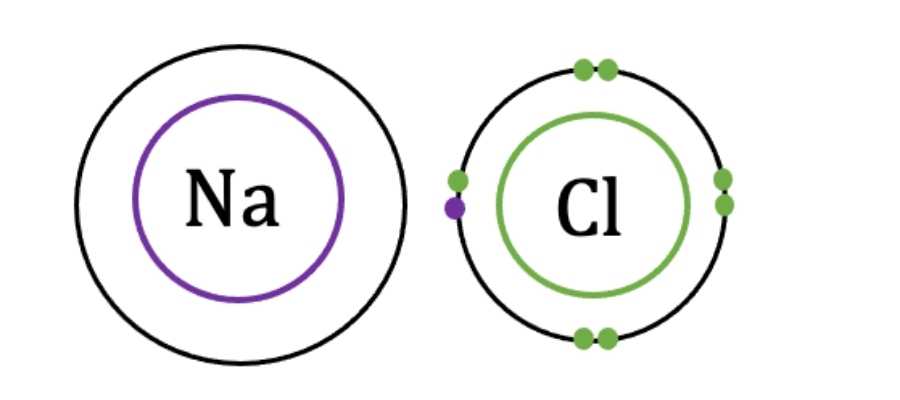
- على سبيل المثال ، يحتوي الصوديوم (Na) على إلكترون تكافؤ واحد في الغلاف الإلكتروني الأخير ، بينما يحتوي الكلور (Cl) على سبعة. عندما يجتمع الصوديوم والكلور معًا ، يتخلى الصوديوم عن إلكترونته إلى الكلور. ثم يضيف هذا 8 إلكترونات تكافؤ.
- عندما يفقد الصوديوم إلكترونًا ، يكتسب شحنة موجبة ويصبح كاتيونًا. عندما يكتسب الكلور إلكترونًا ، يتحول إلى سالب ويصبح أنيونًا.
- نظرًا لأن الشحنات الموجبة والسالبة تجتذب بعضها البعض ، فإن كلا الأيونات يجتمعان معًا لتشكيل رابطة أيونية. هذا المركب الخاص ، المكون من الروابط الأيونية ، هو كلوريد الصوديوم (NaCl) ، الاسم الكيميائي لملح الطعام.
أمثلة على الروابط الأيونية
- بروميد البوتاسيوم (KBr) ، أحد مكونات الأدوية المثلية ، المهدئات ، مضادات الاختلاج ، مدر للبول ، إلخ.
- كربونات الكالسيوم (CaCO 3 ) استخدامات طبية مثل مضادات الحموضة والجهاز الهضمي وغيرها.
- كلوريد الأمونيوم (NH 4 Cl) ، السماد الأساسي.
- كلوريد المغنيسيوم (MgCl 2 ) ، ومن بين خصائصه مضاد التجمد.
- كلوريد المنغنيز (MnCl 2 ) ، ويستخدم في صناعة الدهانات والورنيشات والمطهرات ، إلخ.
- كلوريد الصوديوم (NaCl) ، ملح الطعام الشائع.
- ثنائي كرومات البوتاسيوم (K 2 Cr 2 O 7 ) ، يستخدم في تصنيع الأصباغ ومعالجة الجلود ومعالجة المعادن ، إلخ.
- فلوريد الليثيوم (LiF) المستخدم في صناعة الزجاج والبلورات والمينا والسيراميك.
- فوسفات ثنائي الصوديوم (Na 2 HPO 4 ) ، يستخدم على نطاق واسع كعامل استقرار في منتجات اللحوم.
- يستخدم هيدروكسيد البوتاسيوم (KOH) في الصابون والمنظفات والأسمدة ، إلخ.
- هيدروكسيد الزنك (Zn (OH) 2 ) ، الذي يستخدم على نطاق واسع لعلاجات الجلد ، مثل الكريمات والبرونزر.
- هيبوكلوريت الصوديوم (NaClO) ، مفيد في تطهير المياه.
- يوديد البوتاسيوم (KI) ، يستخدم كقاعدة للملح المعالج باليود
- نترات الكالسيوم (Ca (NO 3 ) 2 ) ، المطبقة في معالجة مياه الصرف الصحي.
- تسمح نترات الفضة (AgNO 3 ) باكتشاف الكلوريد في المحاليل الأخرى. إنه بمثابة كاوي للإصابات المختلفة.
- أكسيد الكالسيوم (CaO) كالوري.
- أكسيد الحديد II (FeO) ، وهو قاعدة للأصباغ التجميلية وصبغات الجسم.
- أكسيد المغنيسيوم (MgO) ، ملين ومضاد للحموضة يعرف باسم حليب المغنيسيا.
- كبريتات النحاس (CuSO 4 ) ، بمثابة مبيد للفطريات ومنظف حمامات السباحة ومكون من علف الحيوانات.
- كبريتات البوتاسيوم (K 2 SO 4 ) ، لها تطبيقات كسماد ومكون لبعض مواد البناء.
ماهو الفرق بين الروابط الأيونية والروابط التساهمية؟
- الفرق الأكثر أهمية بين الروابط الأيونية والتساهمية هو أن الروابط الأيونية تنقل إلكترونًا من ذرة إلى أخرى. في المقابل ، في الروابط التساهمية ، تشترك الذرات في زوج من الإلكترونات.
- عادة ما تحدث الروابط الأيونية بين العناصر المعدنية وغير المعدنية. يتم إنشاء الروابط التساهمية فقط بين العناصر اللافلزية.
- يكمن اختلاف آخر في نوع المركبات التي تولد كلا الرابطين. تتكون معظم المركبات غير العضوية من روابط أيونية. المركبات العضوية ، من جانبها ، تتكون دائمًا من روابط تساهمية.
